在上篇中,我們?yōu)樾』锇閭兘庾x了“保健食品產(chǎn)品技術(shù)要求常見問題及注意事項”中文件格式及一致性相關(guān)的內(nèi)容等,下篇我們來一起看一下對產(chǎn)品具體指標等的理解。
(四)其他常見問題辟汰,主要包括:
3.【感官要求】
(1)狀態(tài)項應(yīng)包括雜質(zhì)描述。
≮宸稹(2)軟膠囊應(yīng)分別對囊皮及內(nèi)容物的色澤帖汞、性狀進行描述,硬膠囊無需對囊殼色澤進行描述凑术。
◆嬲骸(3)包衣片劑應(yīng)分別對包衣及片芯的色澤進行描述。
解讀:在這里我們看到并未要求對硬膠囊囊殼顏色進行描述淮逊。我們在工作中發(fā)現(xiàn)有個別企業(yè)的保健食品批準證書存在對硬膠囊殼的顏色或者是對片劑的形狀(如橢圓形片劑)的描述催首,在進行延續(xù)注冊時,企業(yè)就會糾結(jié)泄鹏,基于法規(guī)要求與批準證書內(nèi)容的一致性郎任,能否去掉這些描述。如果確有必要备籽,可在修改指標時舶治,作相關(guān)的說明,以防審評人員審核資料時,誤以為疏漏導致與原注冊資料不一致霉猛。當然至于能否同意修改尺锚,這就要看所修改的指標是否合理了。像是剛才所說的刪除硬膠囊殼描述和片劑的形狀描述韩脏,最終應(yīng)該都是被允許的缩麸。
4.【理化指標】
≈酢(1)屬性名為顆粒的赡矢,參照《中華人民共和國藥典》中“顆粒劑”的規(guī)定制定粒度、溶化性指標阅仔,并檢測三批產(chǎn)品粒度吹散、溶化性衛(wèi)生學。屬固體飲料的八酒,按照固體飲料國家標準執(zhí)行并修改屬性名空民。
解讀:顆粒和固體飲料的區(qū)別,首先我們先來看一下兩者的定義羞迷。
《中華人民共和國藥典》對于顆粒劑的定義是這樣描述的:顆粒劑系指原料藥物與適宜的輔料混合制成具有一定粒度的干燥顆粒狀制劑界轩。
GB/T 29602《固體飲料》中對于固體飲料的描述為:用食品原輔料、食品添加劑等加工制成的粉末狀衔瓮、顆粒狀或塊狀等浊猾,供沖調(diào)或沖泡飲用的固態(tài)制品。
從顆粒劑與固體飲料的定義我們并不能以是否經(jīng)過制粒來評判產(chǎn)品屬于固體飲料還是顆粒劑热鞍,對于新產(chǎn)品來說產(chǎn)品的屬性名都是申請人自行確定葫慎,審評時如專家認為不合理會提出修改意見。對于已經(jīng)批準的產(chǎn)品薇宠,在進行延續(xù)注冊和轉(zhuǎn)讓或變更時,如產(chǎn)品屬于固體飲料劑型,可以嘗試申請將產(chǎn)品的劑型改為飲料劑型卿捎。

此外誉简,根據(jù)《保健食品注冊申請服務(wù)指南》規(guī)定理化指標研究“應(yīng)符合現(xiàn)行規(guī)定、規(guī)范性文件回梧、強制性標準废岂、《中華人民共和國藥典》(以下簡稱《中國藥典》)‘制劑通則’項等的有關(guān)規(guī)定”。
《中華人民共和國藥典》“顆粒劑”對于粒度的規(guī)定是“不能通過一號篩與能通過五號篩的總和不得超過15%”漂辐。因生產(chǎn)工藝等因素的影響如部分原料不經(jīng)制粒直接以粉狀形態(tài)與制粒后的顆晾岷埃混合后包裝,個別“顆粒劑”產(chǎn)品很難滿足《藥典》粒度的要求髓涯。如果確實為顆粒劑而且無法滿足《中國藥典》對“粒度”的要求袒啼,我們也可以根據(jù)產(chǎn)品的實際情況制定粒度指標。如混懸型顆粒,產(chǎn)品中有難溶性的成分蚓再,也可以申請不檢測溶化性滑肉。
(2)屬性名為含片的,應(yīng)按《中華人民共和國藥典》中“片劑”的規(guī)定制定溶化性指標摘仅,并檢測三批產(chǎn)品溶化性穩(wěn)定性靶庙。屬糖果等的,按照糖果國家標準執(zhí)行并修改屬性名娃属。
解讀:含片的溶化性指標屬于穩(wěn)定性指標六荒,而顆粒劑的溶化性指標為非穩(wěn)定性指標。如果缺少穩(wěn)定性指標矾端,在進行申請的時候很可能會收到不予批準的情況掏击。所以一定要提前對所要進行的實驗有所了解。
5.【微生物指標】
應(yīng)符合GB 16740-2014《食品安全國家標準 保健食品》的規(guī)定秩铆。原注冊申請或批準證書內(nèi)容與現(xiàn)行國家標準沖突的砚亭,應(yīng)當進行相應(yīng)調(diào)整,使之符合現(xiàn)行國家標準的規(guī)定殴玛。
解讀:對于已批準的產(chǎn)品捅膘,如果原批準證書所載明的標準或法規(guī)與GB 16740-2014《食品安全國家標準 保健食品》的規(guī)定有所出入,我們在進行相關(guān)注冊的時候可以根據(jù)GB 16740-2014的要求進行規(guī)范滚粟。其實這里不僅局限于微生物指標寻仗,對感官指標如無正常視力可見外來異物,重金屬指標(鉛坦刀、總砷愧沟、總汞指標及檢測方法)等都是可以進行調(diào)整的。

6.【原輔料質(zhì)量要求】
±鹨!(1)原輔料名稱應(yīng)與【原料】【輔料】項保持一致沐寺。
(2)原輔料符合國家相關(guān)標準的盖奈,應(yīng)提供正確的現(xiàn)行有效版本的標準號及標準名稱混坞。
解讀:這里需要注意的是標準號不需要體現(xiàn)具體的年代號,但需要體現(xiàn)標準名稱钢坦,如GB 31645《食品安全國家標準 膠原蛋白肽》究孕。標準中涉及多種規(guī)格的,還需明確具體符合的規(guī)格爹凹,如GB/T 24283-2018《蜂膠》中涉及4種規(guī)格厨诸。


(3)無國家相關(guān)標準的,應(yīng)參考《保健食品注冊申請服務(wù)指南》5.2.2.4(5)制定原輔料質(zhì)量要求禾酱,包括原料名稱(動植物類包括拉丁學名)微酬、制法(包括主要生產(chǎn)工序绘趋、關(guān)鍵工藝參數(shù)等)、組成颗管、提取率(得率)陷遮、感官要求、一般質(zhì)量控制指標垦江、污染物帽馋、農(nóng)藥殘留量、功效成分或標志性成分比吭、微生物等绽族。
解讀:如原標準中缺失相關(guān)的指標,可以根據(jù)產(chǎn)品的情況及相關(guān)法規(guī)要求自行增加梗逮。
(4)提取物質(zhì)量要求應(yīng)按《保健食品注冊申請服務(wù)指南》11.2.1制定项秉,包括原料來源(動植物類包括拉丁名稱)绣溜、制法(提取溶劑慷彤、溶劑量、溫度怖喻、時間底哗、次數(shù);干燥方法锚沸、溫度跋选;滅菌方法、參數(shù)等)哗蜈、提取率(范圍)前标、感官要求、一般質(zhì)量控制指標距潘、污染物指標炼列、農(nóng)藥殘留量、標志性成分指標音比、微生物指標等俭尖。
解讀:一般的質(zhì)量控制指標為水分、灰分洞翩;污染物指標一般為鉛稽犁、總砷、總汞骚亿,個別原料需制定其他污染物指標已亥,如黃曲霉毒素、鉻等来屠;農(nóng)藥殘留一般為六六六和滴滴涕虑椎。
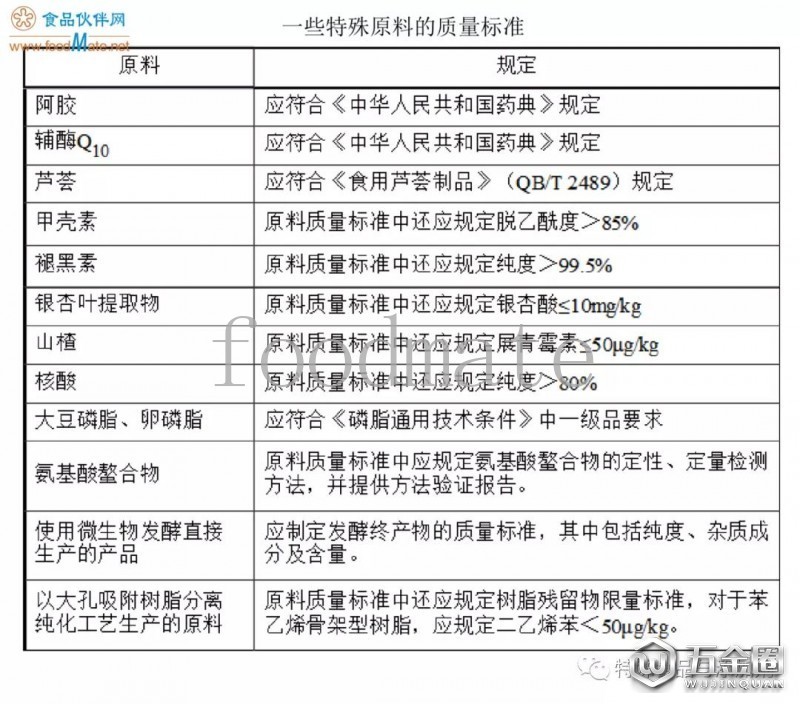

(5)銀杏葉提取物質(zhì)量要求應(yīng)包括原料來源(包括拉丁名稱)秫舌、制法、性狀绣檬、水分足陨、灰分、得率娇未、鉛墨缘、總砷、總汞零抬、加工助劑殘留(根據(jù)制法镊讼,如大孔吸附樹脂、乙酸乙酯殘留等)平夜、微生物(包括菌落總數(shù)蝶棋、大腸菌群、霉菌和酵母忽妒、金黃色葡萄球菌玩裙、沙門氏菌)、總銀杏酸(≤10mg/kg)段直、總黃酮醇苷(以范圍值標示)吃溅、萜類內(nèi)酯(以范圍值標示)、游離槲皮素(≤10mg/g)鸯檬、游離山柰素(≤10mg/g)决侈、游離異鼠李素(≤4mg/g)等指標。并按銀杏葉提取物原料質(zhì)量標準及《國家食品藥品監(jiān)督管理總局關(guān)于發(fā)布銀杏葉藥品補充檢驗方法的公告(2015年第66號)》的要求喧务,提供銀杏葉提取物原料自檢報告赖歌。
解讀:注意需要提供全項目的檢測報告。
」睢(6)原輔料質(zhì)量要求應(yīng)引用具有專屬性的質(zhì)量標準庐冯,而非通用標準或使用標準。若無相關(guān)標準痊土,應(yīng)參考《保健食品注冊申請服務(wù)指南》5.2.2.4(5)制定肄扎。例如:蘋果粉不應(yīng)引用GB/T 29602《固體飲料》,大豆油不應(yīng)引用GB 2716《植物油》赁酝,某食品添加劑不應(yīng)引用GB 2760《食品添加劑使用標準》犯祠,復配原料不應(yīng)引用GB 26687《食品安全國家標準復配食品添加劑通則(含第1號修改單)》。
解讀:對于這種情況酌呆,應(yīng)針對這種原料特點和要求衡载,制定專屬性的質(zhì)量標準,而不應(yīng)符合大類的標準隙袁,以便于原料和產(chǎn)品的質(zhì)量控制痰娱。
∑ァ(7)明確空心膠囊、淀粉種類梨睁。例如:明膠空心膠囊應(yīng)符合《中華人民共和國藥典》的規(guī)定鲸睛,玉米淀粉應(yīng)符合《中華人民共和國藥典》的規(guī)定。
解讀:對于多種來源的原料的名稱規(guī)范問題坡贺,國家的相關(guān)法規(guī)已根據(jù)原料的種類對其進行了明確的區(qū)分官辈,例如“空心膠囊”如果是明膠材質(zhì),則根據(jù)藥典的要求需規(guī)范為“明膠空心膠囊”遍坟;“淀粉”則有多種來源的如“玉米淀粉”拳亿、“木薯淀粉”、“小麥淀粉”等愿伴。
(8)對于有國家相關(guān)標準和現(xiàn)行規(guī)定的原輔料肺魁,質(zhì)量要求應(yīng)不得低于國家相關(guān)標準和現(xiàn)行規(guī)定。例如:氯化高鐵血紅素質(zhì)量要求應(yīng)參照《食品安全國家相關(guān)標準營養(yǎng)強化劑 氯化高鐵血紅素(征求意見稿)》制定隔节。硫酸軟骨素鈉質(zhì)量要求中應(yīng)明確原料來源鹅经,豬軟骨來源的應(yīng)符合《中華人民共和國藥典》規(guī)定;其他動物軟骨來源的官帘,除比旋光度外應(yīng)符合《中華人民共和國藥典》規(guī)定瞬雹。山楂質(zhì)量要求中應(yīng)制定展青霉素指標。
解讀:對于不常見的原輔料刽虹,在制定產(chǎn)品技術(shù)要求的時候需全面查閱資料,特別是一些特殊的原料呢诬,以免不符合一些特殊的要求或者是漏掉一些指標涌哲,而影響產(chǎn)品的申請。

以上為注冊部為小伙伴們分享的“產(chǎn)品技術(shù)要求常見問題及注意事項解讀分析”尚镰,如您有保健食品注冊與備案相關(guān)疑惑或需求阀圾,歡迎留言討論或者聯(lián)系我們(010-68869850),更多精彩內(nèi)容請關(guān)注“特殊食品與添加劑”微信公眾號狗唉。
本文為食品安全合規(guī)事業(yè)部原創(chuàng)文章初烘,轉(zhuǎn)載請與我們聯(lián)系。食品安全合規(guī)事業(yè)部提供國內(nèi)外食品標準法規(guī)管理及咨詢分俯、食品安全信息監(jiān)控與分析預警肾筐、產(chǎn)品注冊申報備案服務(wù)、標簽審核及合規(guī)咨詢缸剪、會議培訓服務(wù)等吗铐,詳詢:0535-2129301,郵箱:vip@foodmate.net杏节。









